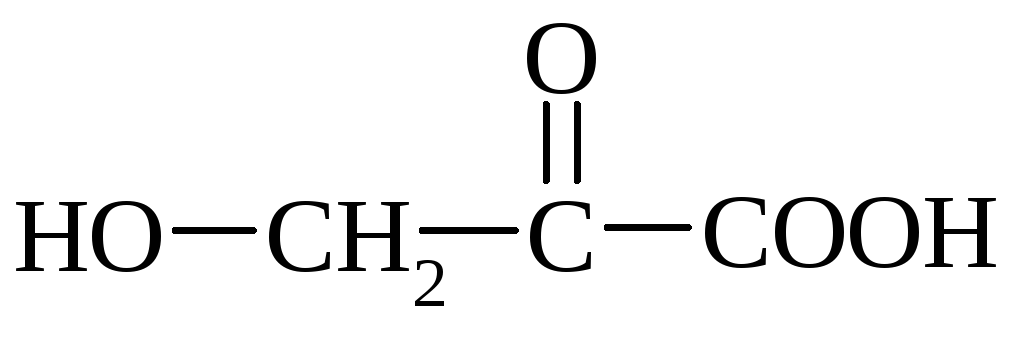
Молочная кислота
МОЛОЧНАЯ КИСЛОТА
(2-гидроксипропионовая к-та) СН 3 СН(ОН)СООН, мол. м. 90,1; бесцв. кристаллы. Известны Д(+)-молочная к-та, D(—)-молочная (мясо-молочная) к-та и рацемич. Молочная кислота-молочная к-та брожения. Для D,L- и D-молочной кислоты т.пл. соотв. 18 °С и 53 °С; т. кип. соотв. 85°С/1 мм рт.ст. и 103°С/2мм рт.ст.; для D-молочной кислоты [a] D 20 -2,26 (концентрация 1,24% в воде). Для D,L-молочной кислоты DH 0 обр - 682,45 кДж/моль; DH 0 пл 11,35 кДж/моль; DH исп 110,95
кДж/моль (25°С), 65,73 кДж/моль (150°С). Для L-молочной кислоты DH 0 сгор - 1344,8 кДж/моль; DH 0 обp -694,54 кДж/моль; DH 0 пл 16,87 кДж/моль.
Из-за высокой гигроскопичности молочной кислоты обычно используют ее концентрир. водные р-ры-сиропообразные бесцв. жидкости без запаха. Для водных р-ров молочной кислоты d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 и 28,5 мПа. с (25 0 С) соотв. для 45,48 и 85,32%-ных р-ров; g 46,0 . 10 -3 Н/м(25°С)для 1 М р-ра; е 22 (17°С). Молочная кислота раств. в воде, этаноле, плохо-в бензоле, хлороформе и др. галогенуглеводородах; рK а 3,862 (25 °С); рН водных р-ров 1,23 (37,3%), 0,2 (84,0%).
Окисление молочной кислоты обычно сопровождается разложением. При действии HNO 3 или О 2 воздуха в присут. Сu или Fe образуются НСООН, СН 3 СООН, (СООН) 2 , СН 3 СНО, СО 2 и пировиноградная к-та. Восстановление молочной кислоты HI приводит к пропионовой к-те, а восстановление в присут. Re-черни - к пропиленгликолю.
Молочная кислота дегидратируется до акриловой к-ты, при нагр. с НВr образует 2-бромпропионовую к-ту, при взаимод. Са-соли с РСl 5 или SОСl 2 -2-хлорпропионилхлорид. В присут. минер. к-т происходит самоэтерификация молочной кислоты с образованием лактона ф-лы I, а также линейныхполиэфиров. При взаимод. молочной кислоты со спиртами образуются гидроксикислоты RCH 2 CH(OH)COOH, a при взаимод. солей молочной кислоты со
спиртамиэфиры. Соли и эфиры молочной кислоты наз. лактатами (см. табл.).
Молочная кислота образуется в результате молочнокислого брожения (при скисании молока, квашении капусты, солении овощей, созревании сыра, силосовании кормов); D-Молочная кислота обнаружена в тканях животных, растений, а также в микроорганизмах.
В пром-сти молочную кислоту получают гидролизом 2-хлорпропионовой к-ты и ее солей (100 °С) или лактонитрила CH 3 CH(OH)CN (100 °С, H 2 SO 4) с послед. образованием эфиров, выделение и гидролиз к-рых приводит к продукту высокого качества. Известны др. способы получения молочной кислоты:окисление пропилена оксидами азота (15-20°С) с послед. обработкой H 2 SO 4 , взаимод. СН 3 СНО с СО (200 °С, 20 МПа).
СВОЙСТВА НЕКОТОРЫХ ЛАКТАТОВ
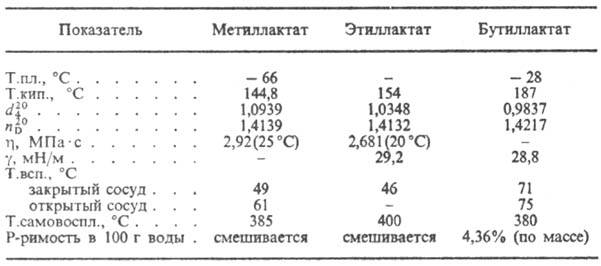
М олочную кислоту применяют в пищ. пром-сти, в протравном крашении, в кожевенном произ-ве, в бродильных цехах в качестве бактерицидного ср-ва, для получения лек. ср-в, пластификаторов. Этил- и бутиллактаты применяют в качестве р-рителей эфиров целлюлозы, олиф, растит. масел; бутил-лактат-также как р-ритель нек-рых синтетич. полимеров.
Каталожный номер на молочную кислоту:
CAS 50-21-5
Описание молочной кислоты:
Почти прозрачная, слегка желтоватая гигроскопичная сиропообразная жидкость со слабо кислым запахом, напоминающим запах простокваши. Растворима в воде, этаноле, плохо - в бензоле, хлороформе и других галогенуглеводородах. Существует различных оптически активных изомерах D и L форма. А также оптически неактивная смесь D и L. Последняя получается при химическом синтезе, а активные формы при бактериальном. (ферментном способе) В организме человека, в цикле Крепса принимает участие именно оптическиактивная форма L именно поэтому ее рекомендовано использовать как добавку (Lactic acid, E270), в других отраслях это не играет особой роли.
Общемировое название Лактановая кислота (Lactic acid) в России не прижилось, но название ее солей лактатов встречается повсеместно, гораздо чаще чем молочнокислый кальций мы слешем лактат кальция.
Спецификация на молочную кислоту 80%.
Точка кипения (100 % раствор) 122 °С (115 мм Hg)
Удельный вес (20 °С) 1,22
Растворимость в воде Полностью растворима
Плотность (при 20°С) 1,18-1,20 г/мл
Тяжелые металлы, не более 0,001 %
Содержание железа, не более 0,001 %
Содержание мышьяка, не более 0,0001 %
Содержание хлоридов, не более 0,002% (по факт.0,0015 %)
Содержание сульфатов, не более 0,01% (по факт.0,004 %)
Остаток после прокаливания, не более 0,1% (по факт.0,06 %)
Производитель:
Китай
Фасовка:
бочки 25 кг или кубы 1200кг
Основные физические свойства молочной кислоты:
Температура плавления: 17°C Для оптически неактивной (рацематической),
25-26 °C оптически активная + или - форма
(различия в температуррах плавления позволяет качественно и быстро отличить более дорогие оптическиактивные формы от более дешевых неактивных!!)
Относительная плотность (вода = 1): 1.2
Растворимость в воде: смешивается
Молекулярная масса: 90.08 г/моль
Температура вспышки: 110°C c.c.
Koэффициент распределения октанол/вода как lg Pow: -0.6
Взрыво- и пожароопасность:
Поддерживает горение при нормальных условиях. самовозгорание мало вероятноНе допускать открытого огня курения.
Ликвидация пожара: порошком, спиртоустойчивой пеной, разбрызгиванием воды,
двуокисью углерода.
Химическая стабильность:
Стабилна при нормальных температурах и давлении.
Избегать условий: Образование пыли, чрезмерное нагревание.
Несовместимость с другими материалами:
Сильные окислители, минеральные кислоты.
Опасные продукты разложения
: Окиси азота, угарный газ, углекислый газ, пары
цианида.
Опасная полимеризация:
Не отмечена.
Опасность для человека:
Пути поступления в организм: Вещество может всасываться в организм при вдыхании аэрозоля и через рот.
При кратковременном воздействии концентраций превышающих ПДК:
Вещество раздражает кожу и дыхательные пути, а также оказывает разъедающее
действие на глаза. Разъедающее действие при проглатывании.
При попадании в глаза:
Покраснение. Боль. Сильные глубокие ожоги. Защитные очки-маска, или
защитная маска. Вначале промыть большим количеством воды в течение нескольких
минут (снять контактные линзы, если это не трудно), затем доставить к врачу.
Нормативы рабочей зоны:
TLV (предельная пороговая концентрация, США) не установлена.
Канцерогенность:
Not listed by ACGIH, IARC, NTP, or CA Prop 65.
Эпидемиология:
Нет информации.
Тетратогенность:
Нет информации.
Репродуктивные эффекты:
Нет информации.
Мутагенность:
нет информации
Нейротоксичность:
Нет информации.
Опыты на животных показали:
LD50/LC50:
Draize тест, кролик, глаза: 100 mg Severe;
Draize тест, кролик, кожа: 500 mg/24H Mild;
Ингаляция, крыса: LC50 = >26 mg/m(куб)/1H;
Орально, мышь: LD50 = 1940 mg/kg;
Орально, крыса: LD50 = 1700 mg/kg;
Кожа, кролик: LD50 = >10 gm/kg;
Внимание. Информация дана о концентрате вещества, в небольших количествах и концентрациях молочная кислота, по имеющемся на данный момент данным безвредна!
Молочная кислота (лактат) - α-оксипропионовая (2-гидроксипропановая) кислота.
- t пл 25-26 °C оптически активная (+)- или (-)-форма.
- t пл 18 °C рацемическая форма.
- Химическая формула: CH 3 CH(OH)COOH
- Рацемическая формула: C 3 H 6 O 3
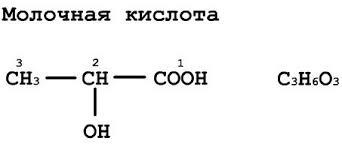
Молочная кислота образуется при молочнокислом брожении сахаров, в частности, в прокисшем молоке, при брожении вина и пива. Ее используют как в химической, так и в пищевой промышленности – в качестве консерванта. В организме человека молочная кислота (лактат) формируется при распаде глюкозы.
Так есть ли разница между молочной кислотой и лактатом? Нет. В органической химии чаще называют молочная кислота, в биохимии — лактат.
Лактат, окружает наверное самое большое количество различных мифов, большая часть из которых не соответствуют действительности. И хотя достоверных материалов о лактате достаточно и на русском языке, многочисленные спортсмены-любители (да и некоторые профессионалы) упорно продолжают верить и повторять мифы прошлого века.
Давайте кратко и тезисно повторим основные факты о лактате.
Лактат образуется всегда при производстве энергии в организме.
Основной путь поступления энергии в клетки это деградация глюкозы. Молекула глюкозы подвергается серии из 10 последовательных реакций чтобы получился пируват в ходе процесса называемого гликолиз. Далее одна часть пирувата частично окисляется и превращается в двуокись углерода и воду. Другая часть превращается в лактат под контролем фермента лактатдегидрогеназы.
Эта реакция является обратимой.
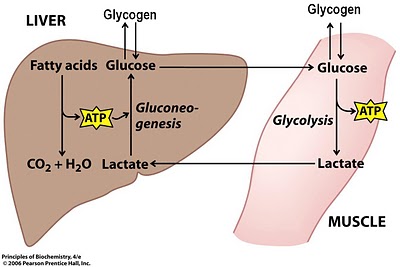
Часть лактата используется для синтеза энергии.
От 15 до 20 процентов от общего количества лактата превращается в гликоген в процессе глюконеогенеза.
Лактат универсальный переносчик энергии.
В условиях высокого производства энергии в анаэробном режиме, лактат является переносчиком энергии из тех мест в которых невозможно провести трансформацию энергии, вследствие повышенной кислотности, в те места в которых она может быть трансформирована в энергию (сердце, дыхательные мышцы, медленно сокращающиеся мышечные волокна, другие группы мышц).
Рост уровня лактата не является следствием недостатка кислорода.
Исследования на животных показывает, что внутриклеточный дефицит кислорода в изолированной мышце не показывает никаких ограничений активности дыхательной цепи митохондрий даже во время максимальной нагрузки. У нас всегда будет достаточно кислорода в мышцах.
Лактат является индикатором нагрузки анаэробного гликолиза.
Каждый раз когда происходит образование пирувата, конечного продукта метаболизма глюкозы в процессе гликолиза, происходит образование лактата. Лактат накапливается просто потому, что скорости трансформации энергии в анаэробной и аэробной нагрузках отличаются.
Чем выше интенсивность работы тем больше производится лактата.
Уровень лактата в крови тесно связан с интенсивностью выполнения упражнения. Лактат накапливается из-за разницы скорости трансформации энергии в анаэробной и аэробной нагрузках. Скорость трансформации энергии при анаэробном метаболизме энергии быстрее чем при аэробном.
Лактат не создает кислотность, он её сопровождает.
Производя энергию мы одновременно производим кислотность. Энергетические реакции в нашем организме происходят при участии электронов как переносчиков энергии. Продуктами глюколиза являются лактат и протон водорода Н+. Мера активности (концентрация) ионов водорода (H+) в растворе выражает его кислотность.
Лактат только на время берет кислотного агента (Н+) для проведения реакции далее возвращая его в нейтральную среду.
90% лактата утилизируется организмом в первый час после тренировки.
60% лактата в организме полностью окисляется до СО2 и воды. Около 20% превращается в гликоген в процессе глюконеогенеза, часть используется для новообразования аминокислот. Лишь малая часть (менее 5%) лактата выделяется с потом и мочой.
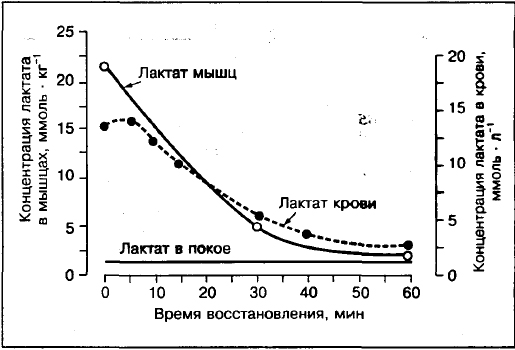
Лактат в крови не будет систематически отражать присутствие лактата в мышцах.
Сравнения концентрации лактата в мышцах и крови показывают, что если усилие превышает 75-80% VO2max то концентрация лактата в мышцах (биопсия мышц передней поверхности бедра) выше чем в крови. В отличие от занятий умеренной интенсивности 30%,50%,70% VO2max где концентрация лактата в артериальной крови выше чем в мышцах.
Лактат не вызывает боль и судороги в мышцах.
Болезненные ощущения в мышцах на следующий день после интенсивной тренировки вызваны повреждениями мышц и воспалением тканей, которые происходят после выполнения упражнения. Большинство мышечных судорог вызывается нервными рецепторами мышц, которые перевозбуждаются с появлением усталости в мышцах.
По материалам cmtscience.com (2016).
Оксикислоты (спиртокислоты) – это производные карбоновых кислот, содержащие в радикале, соединенном с карбоксилом, одну, две или несколько гидроксильных групп.
В зависимости от количества карбоксильных групп оксикислоты делятся на одноосновные, двухосновные и т.д.; в зависимости от общего количества гидроксильных групп оксикислоты делятся на одно- или многоатомные.
По характеру радикала оксикислоты бывают предельные и непредельные, ациклические, циклические или ароматические.
В оксикислотах встречаются следующие виды изомерии:
структурная (изомерия цепи радикала, изомерия взаимного положения карбоксила и гидроксила);
оптическая (зеркальная), обусловленная наличием асимметричных атомов углерода.
Названия оксикислотам дают по названию кислоты с добавлением «окси» или «диокси» и т.д. Широко используется и тривиальная номенклатура.
НО–СН 2 –СООН
гликолевая (оксиуксусная)
молочная (α-оксипропионовая)
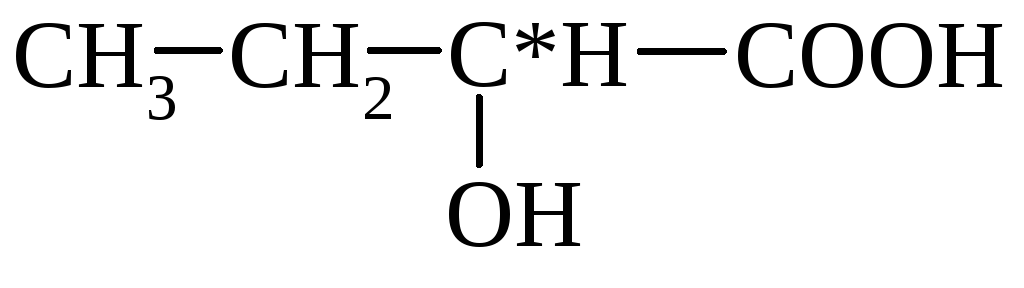
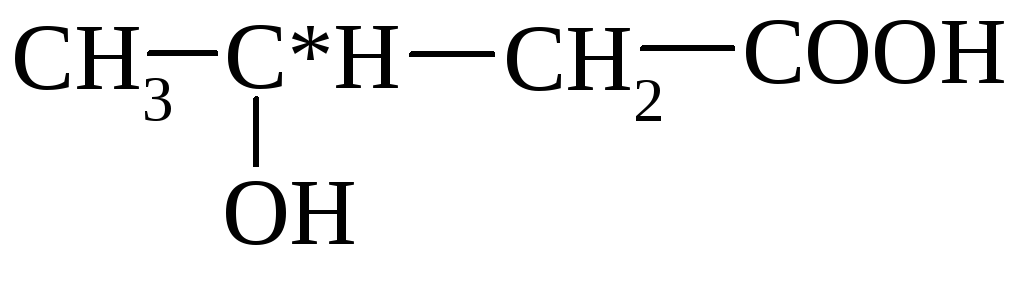
α-оксимасляная β-оксимасляная
(2-оксибутановая) (3-оксибутановая)
Физические свойства. Низшие оксикислоты чаще всего – это густые, сиропообразные вещества. Оксикислоты смешиваются с водой в любых соотношениях, а с ростом молекулярной массы растворимость уменьшается.
Химические свойства.
1. Кислотные свойства – оксикислоты дают все реакции, характерные для карбоксила: образование солей, сложных эфиров, амидов, галогенангидридов и т.п. Гидроксикислоты – более сильные электролиты, чем соответствующие им карбоновые кислоты (влияние гидроксильной группы).
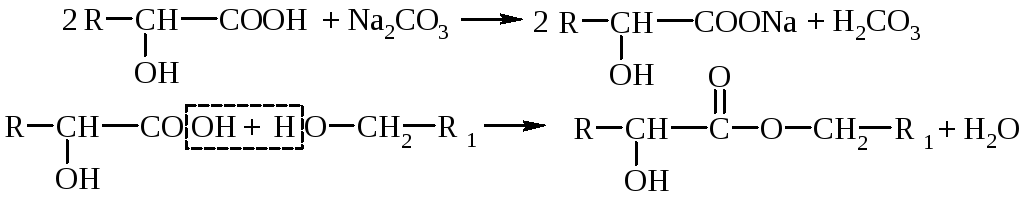
2. Спиртовые свойства – реакции замещения водорода гидроксигруппы, образование простых и сложных эфиров, замещение –OHна галоген, внутримолекулярная дегидратация, окисление.
хлоруксусная гликолевая глиоксалевая
кислота кислота кислота
а) НО–СН 2 –СООН + СН 3 OHНО–СН 2 –СО–О–СН 3 + Н 2 О
сложный эфир гликолевой кислоты и метилового спирта
б) НО–СН 2 –СООН + 2СН 3 ОНСН 3 –О–СН 2 –СООСН 3 + 2Н 2 О
гликолевая метиловый метиловый эфир
кислота спирт метоксиуксусной кислоты
(полный эфир)
3. Отношение оксикислот к нагреванию – при нагревании α-оксикислоты отщепляют воду, образуя циклический сложный эфир, построенный ид двух молекул α-оксикислот:
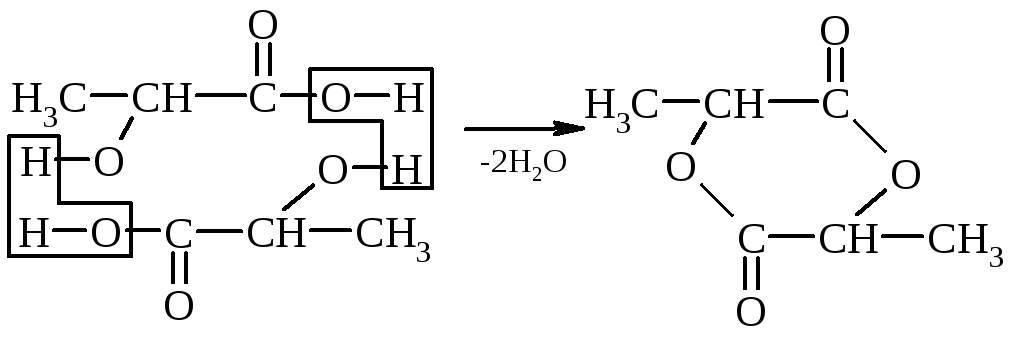
α-оксипропионовая кислота лактид
β-Оксикислоты в тех же условиях легко теряют воду с образованием непредельных кислот.
НО–СН 2 –СН 2 –СООН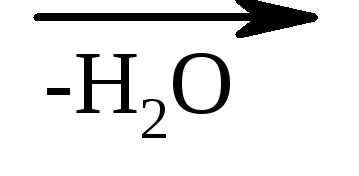 СН 2 =СН–СООН
СН 2 =СН–СООН
β-оксипропионовая акриловая кислота
γ-Оксикислоты тоже могут терять молекулу воды с образованием внутримолекулярных эфиров – лактонов.
НО–СН 2 –СН 2 –СН 2 –СООН
γ-оксимасляная кислота
γ-бутиролактон
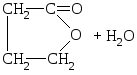
Некоторые оксикислоты получаются из природных продуктов. Так, молочную кислоту получают при молочно-кислом брожении сахаристых веществ. Синтетические способы получения основаны на следующих реакциях:
1) Cl–СН 2 –СООН +
НОН НО–СН 2 –СООН;
НО–СН 2 –СООН;
монохлоруксусная гликолевая
кислота кислота
2) СН 2 =СН–СООН + НОН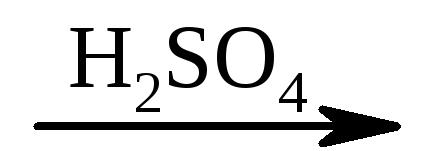 НО–СН 2 –СН 2 –СООН.
НО–СН 2 –СН 2 –СООН.
акриловая кислота β-оксипропионовая кислота
Представители оксикислот.
Гликолевая (оксиуксусная) кислота – кристаллическое вещество, содержащееся в незрелых фруктах, в свекловичном соке, репе и других растениях. В промышленности получается восстановлением щавелевой кислоты. Применяется при крашении (ситцепечатание).
Молочная кислота (α-оксипропионовая) – густая жидкость или легкоплавкая кристаллическая масса. Молочная кислота образуется в процессе молочно-кислого брожения сахаров, под действием молочно-кислых бактерий. Содержится в кисломолочных продуктах, квашеной капусте, силосе. Используется при протравном крашении, в кожевенном производстве, в медицине.
Мясомолочная кислота содержится в мускульном соке животных и мясных экстрактах.
Двухатомная глицериновая кислота участвует в процессах жизнедеятельности растений и животных.
Аскорбиновая кислота (витамин С) – кристаллическое вещество, содержащееся в свежих фруктах, лимонах, черной смородине, в свежих овощах – капусте, бобах. Синтетически витамин С получают окислением многоатомного спирта сорбита.
 α-аскорбиновая кислота
α-аскорбиновая кислота
Аскорбиновая кислота легко разлагается кислородом воздуха, особенно при нагревании
Ациклические двух - и трехосновные оксикислоты.
Яблочная (оксиянтарная) кислота (НООС–СНОН–СН 2 –СООН) – это кристаллическое вещество, хорошо растворимое в воде; применяется в медицине, содержится в недозрелой рябине, барбарисе, ревене, в виноградном соке, вине.
Винная (винно-каменная, диоксиянтарная) кислота (НООС–*СНОН–*СНОН–СООН) имеет 2 асимметричных атома углерода и поэтому имеет 4 оптических изомера. Образует кислые калиевые соли, которые плохо растворяются в воде и выпадают в осадок. Кристаллы соли можно наблюдать в вине (винный камень). Смешанная калиево-натриевая соль называется сегнетовой солью. Соли винной кислоты называются тартратами.
винный камень сегнетовая соль
Винная кислота распространена в растениях (рябина, виноград и т.д.).
Лимонная кислота
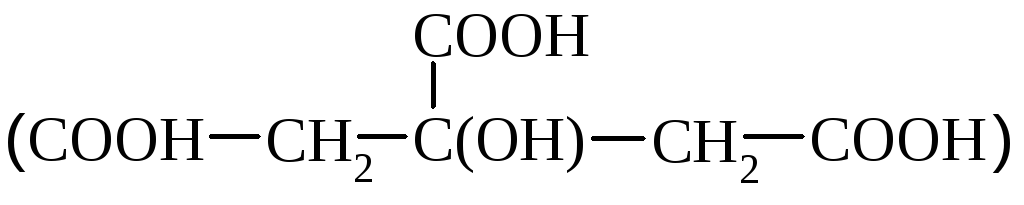 содержится в цитрусовых. В промышленности
получается из плодов лимона, окислением
сахаров плесневыми грибками, при
переработке хвои ели.
содержится в цитрусовых. В промышленности
получается из плодов лимона, окислением
сахаров плесневыми грибками, при
переработке хвои ели.
Лимонная кислота – биологически важное соединение, принимает участие в обмене веществ. Применяется в медицине, пищевой, текстильной промышленности как добавка к красителям.
Циклические одноосновные многоатомные оксикислоты входят в состав желчных кислот и других физиологически важных соединений; например, ауксин усиливает рост растений.
Ароматические оксикислоты подразделяются на фенолокислоты и жирно-ароматические кислоты, содержащие гидроксил в боковой цепи.
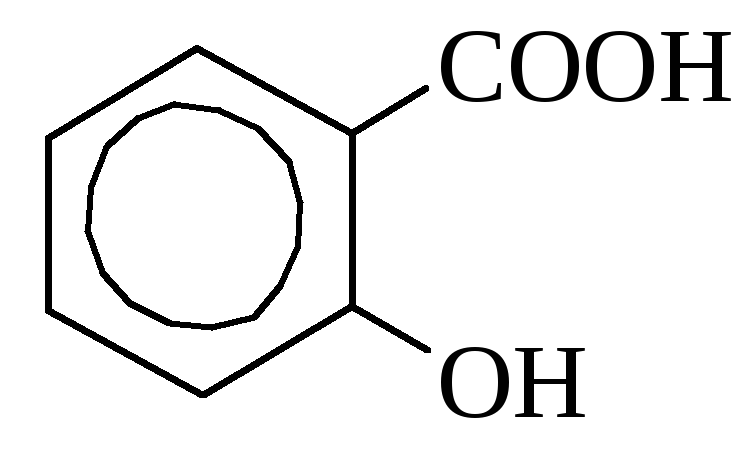
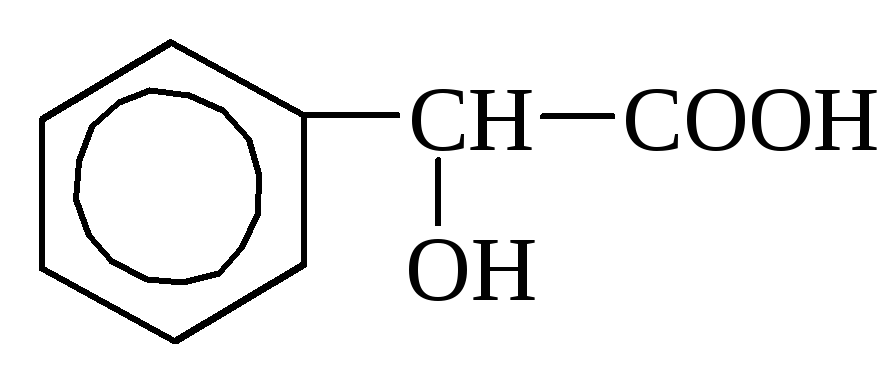
о-оксибензойная миндальная кислота
(салициловая) кислота
Салициловая кислота содержится в некоторых растениях в свободном виде (календула), но чаще в виде сложных эфиров. В промышленности получается путем нагревания фенолята натрия с углекислотой. Используется как дезинфицирующее средство и при синтезе красителей. Многие производные салициловой кислоты применяются как лекарства (аспирин, салол).
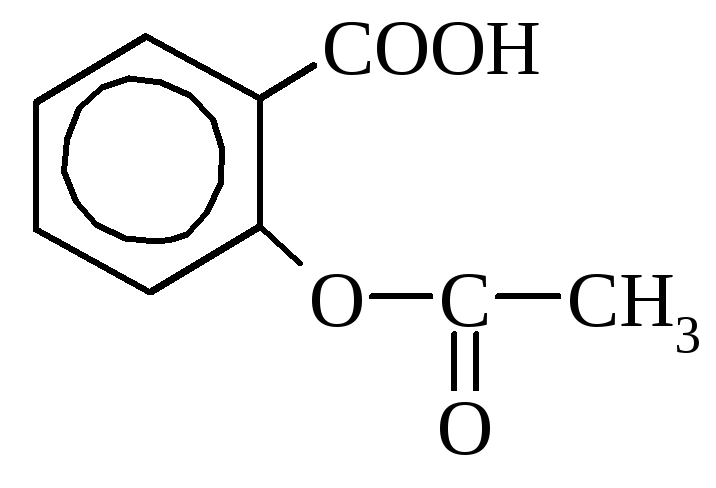
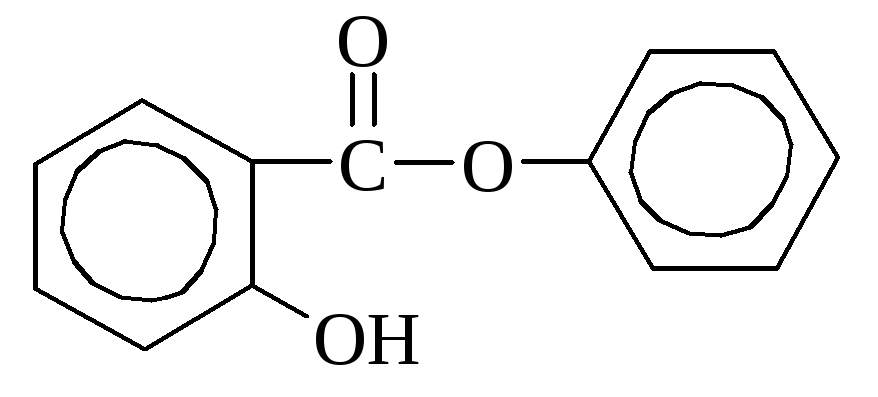
аспирин салол (фениловый эфир
(ацетилсалициловая кислота) салициловой кислоты)
Галловая кислота (3,4,5-триоксибензойная).
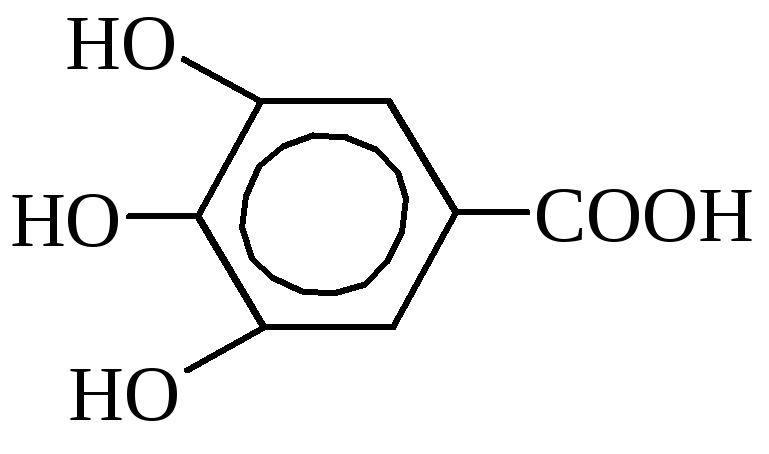
Содержится в листьях чая, дубовой коре, в гранатовом дереве. В промышленности получается из таннина кипячением с разбавленными кислотами. Применяется для изготовления чернил, в фотографии, в медицине как антисептик. Галловая кислота и её производные широко используются в качестве консервантов для многих пищевых продуктов (жиры, высокосортные мыла, молочные продукты), обладает дубильными свойствами и имеет определённое значение в производстве кожи и в протравном крашении.
Миндальная кислота относится к жирно-ароматическим кислотам (С 6 Н 5 –СН(ОН)–СООН), содержится в амигдалине, в горчице, бузине и т.д.
Дубильные вещества часто являются производными многоатомных фенолов. Они входят в состав растений и получаются из экстрактов коры, древесины, листьев, корней, плодов или наростов (галлов).
Таннины являются наиболее важными дубильными веществами. Это смесь разных химических соединений, главными из которых являются эфиры галловой и дигалловой кислот и глюкозы или многоатомных спиртов.
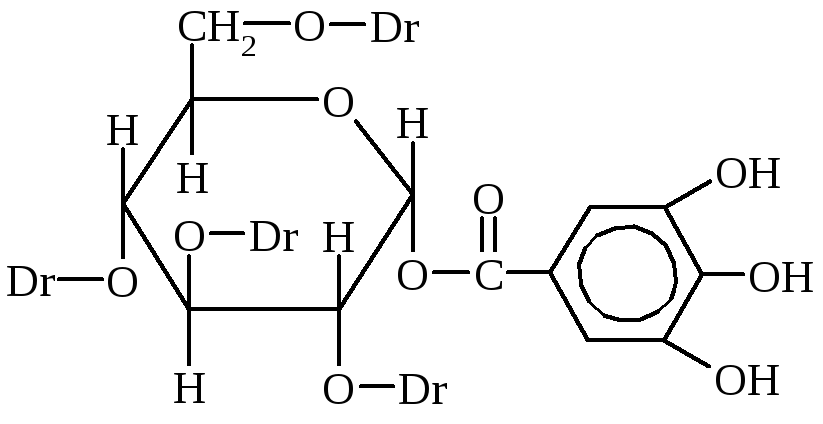
Dг-дигалловая кислота
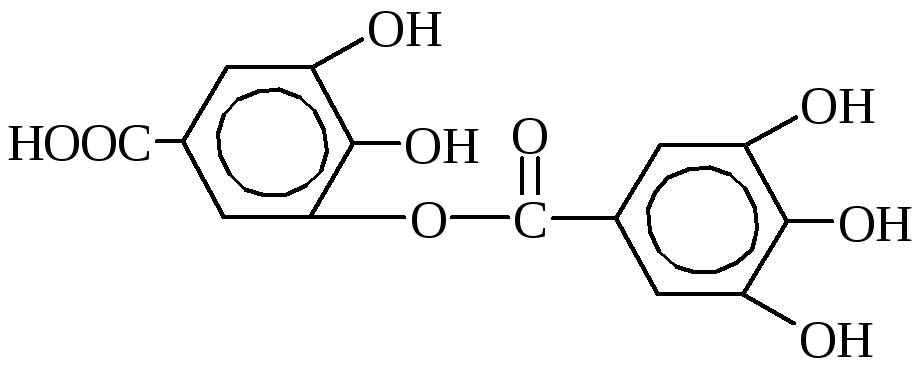
м-дигалловая кислота
Таннин проявляет свойства фенолов и сложных эфиров. С раствором хлорного железа образует комплексное соединение черного цвета. Таннины находят широкое применение как дубильные экстракты, протравы при крашении хлопчатобумажных тканей, как вяжущие вещества в медицине (обладают бактерицидными, кровеостанавливающими свойствами), являются консервантами.
К липидам относятся органические вещества, многие из которых являются сложными эфирами жирных высокомолекулярных кислот и многоатомных спиртов, – это жиры, фосфатиды, воска, стероиды, жирные высокомолекулярные кислоты и др.
Липиды находятся главным образом в семенах растений, ядрах орехов, а в животных организмах – в жировой и нервной тканях, особенно в мозгу животных и человека.
Природные жиры представляют собой смеси сложных эфиров трёхатомного спирта глицерина и высших карбоновых кислот, т.е. смеси глицеридов этих кислот.
О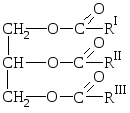 бщая
формула жира:
бщая
формула жира:
где R I R II R III – углеводородные радикалы высших жирных кислот нормального строения с чётным числом углеродных атомов. В состав жиров могут входить остатки как насыщенных, так и ненасыщенных кислот.
Насыщенные кислоты:
С 15 H 31 COOH– пальмитиновая;
С 17 Н 35 СООН – стеариновая;
С 3 Н 7 СООН – масляная (содержится в сливочном масле) и др.
Ненасыщенные кислоты:
С 17 Н 33 СООН – олеиновая;
С 17 Н 31 COOH– линолевая;
С 17 Н 29 СООН – линоленовая и др.
Получают жиры из природных источников животного и растительного происхождения.
Физические свойства жиров обусловлены кислотным составом. Жиры, содержащие преимущественно остатки насыщенных кислот, – твёрдые или мазеобразные вещества (бараний, говяжий жир и др.) Жиры, в составе которых содержатся главным образом остатки ненасыщенных кислот, имеют жидкую консистенцию при комнатной температуре и называются маслами. Жиры не растворяются в воде, но хорошо растворяются в органических растворителях: эфире, бензоле, хлороформе и др.
Химические свойства. Как все сложные эфиры, жиры подвергаются гидролизу. Гидролиз может протекать в кислой, нейтральной или щелочной среде.
1. Кислотный гидролиз.
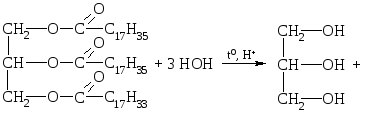
Молочная кислота
(2-гидроксипропионовая кислота) СН 3 СН(ОН)СООН, молекулярная масса 90,1; бесцветные . Известны L(+)-молочная кислота, D(–)-молочная (мясо-молочная) кислота и рацемическая молочная кислота-молочная кислота брожения. Для D,L- и D-молочной кислоты температура плавления соответствует 18 °С и 53 °С; т. кип. соотв. 85°С/1 мм рт.ст. и 103°С/2мм рт.ст.; для D-молочная кислота [α] D
20 -2,26 (концентрация 1,24% в . Для D,L-молочной кислоты DH
0 обр - 682,45 кДж/моль; DH
0 пл 11,35 кДж/моль; DH
исп 110,95 кДж/моль (25°С), 65,73 кДж/моль (150°С). Для L-молочной кислоты DH
0 сгор - 1344,8 кДж/моль; DH
0 обp -694,54 кДж/моль; DH
0 пл 16,87 кДж/моль.
Из-за высокой гигроскопичности молочной кислоты обычно используют ее концентрированные водные растворы - сиропообразные бесцветные без запаха. Для водных растворов молочной кислоты d
20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D
25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 и 28,5 мПа. с (25 0 С) соотв. для 45,48 и 85,32%-ных растворов; g 46,0 . 10 -3 Н/м(25°С)для 1 М раствора; е 22 (17°С). Молочная кислота растворима в , плохо - в , и других галогенуглеводородах; рK а
3,862 (25 °С); рН водных растворов 1,23 (37,3%), 0,2 (84,0%).
Молочная кислота
дегидратируется до акриловой кислоты, при нагревании с НВr образует 2-бромпропионовую кислоту, при взаимодействии Са-соли с РСl 5 или SОСl 2 -2-хлорпропионилхлорид. В присутствии минеральных кислот происходит самоэтерификация молочной кислоты с образованием формулы I, а также линейных полиэфиров. При взаимодействии молочной кислоты со образуются гидроксикислоты RCH 2 CH(OH)COOH, a при взаимодействии молочной кислоты со спиртами-эфиры. Соли и эфиры молочной кислоты называют лактатами (см. табл.).
молочная кислота образуется в результате молочнокислого (при скисании молока, квашении капусты, солении овощей, созревании сыра, силосовании кормов); D-молочная кислота обнаружена в тканях животных, растений, а также в микроорганизмах.
В промышленности молочную кислоту получают 2-хлорпропионовой кислоты и ее (100 °С) или лактонитрила CH 3 CH(OH)CN (100 °С, H 2 SO 4) с последующим образованием эфиров, выделение и гидролиз которых приводит к продукту высокого качества. Известны другие способы получения молочная кислота: окисление пропилена оксидами азота (15-20°С) с последующей обработкой H 2 SO 4 , взаимодействием СН 3 СНО с СО (200 °С, 20 МПа).
СВОЙСТВА НЕКОТОРЫХ ЛАКТАТОВ

молочная кислота применяют в пищевой промышленности, в протравном крашении, в кожевенном производстве, в бродильных цехах в качестве бактерицидного средства, для получения лекарственных средств, пластификаторов. Этил- и бутиллактаты применяют в качестве растворителей эфиров целлюлозы, олиф, растительных масел; бутил-лактат - также как растворитель некоторых синтетических полимеров.
Мировое производство молочная кислота 40 тыс. т (1983).
Лит.:
HoltenC.H., Lactic acid. Properties and chemistry. Lactic acid and derivatives, Weisheim, 1971. Ю. А. Трeгер.
Выберите первую букву в названии статьи:


